Download Pembahasan Soal OSP Kimia 2011 (1-10) – Guna mempersiapkan Olimpiade Sains Nasional tingkat provinsi (OSP) tahun 2019, perlu adanya latihan soal OSP tahun-tahun sebelumnya. Setelah di cek, pembahasan soal Kimia tahun 2011 belum ada, maka pak urip.info nerinisiasi untuk membahasnya. Berikut ialah pembahasan soal OSP Kimia 2011.
Download Pembahasan Soal OSP Kimia 2011 (1-10)
Baca juga: Download Pembahasan Soal OSP Kimia 2004 Hingga 2018
Soal OSP Kimia 2011 Nomor 1
Berikut ini, ion manakah yang mempunyai jumlah elektron lebih banyak dari proton dan jumlah proton lebih banyak dari jumlah neutron? [D = 1H2]
A. D– rukim.id
B. He+
C. OD–
D. D3O+
E. OH–
Pembahasan Soal OSP Kimia 2011 Nomor 1
Jumlah proton = nomor atom; rukim.id
Jumlah neutron = nomor massa – nomor atom;
Jumlah elektron = nomor atom + muatan negatif – muatan positif
1H1 ; 1D2 ; 2He4 ; 8O16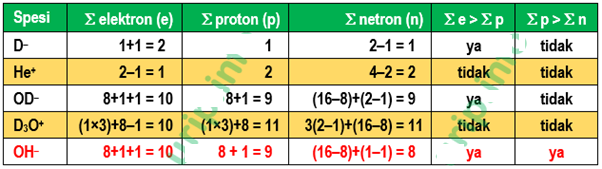
Kunci Jawaban Soal OSP Kimia 2011 : E. rukim.id
Soal OSP Kimia 2011 Nomor 2
Ion etanadioat (C2O42–) dioksidasi oleh larutan kalium manganat(VII) dalam suasana asam sesuai persamaan reaksi berikut:
2MnO4–(aq) + 5C2O42–(aq) + 16H+(aq) → 2Mn2+(aq) + 10CO2(g) + 8H2O(l)
Berapa volume dari larutan 0,02 mol dm–3 kalium manganat(VII) yang diperlukan untuk mengoksidasi tepat 1,0×10–3 mol garam KHC2O4.H2C2O4?
A. 20 cm3
B. 40 cm3 rukim.id
C. 50 cm3
D. 125 cm3
E. 250 cm3
Pembahasan Soal OSP Kimia 2011 Nomor 2
2MnO4–(aq) + 5C2O42–(aq) + 16H+(aq) → 2Mn2+(aq) + 10CO2(g) + 8H2O(l)
Dalam setiap mol garam KHC2O4.H2C2O4 terdapat 2 mol ion C2O42–
1,0×10–3 mol garam KHC2O4.H2C2O4 terdapat 2×(1,0×10–3 mol) ion C2O42–
c = n/V
→ V = n/c
V(MnO4–) = n(MnO4–)/ c(MnO4–)
V(MnO4–) = (8×10–4 mol)/(0,02 mol/dm–3)
V(MnO4–) = 0,04 dm–3
V(MnO4–) = 0,04 dm–3 × 1000 cm3/dm3
V(MnO4–) = 40 cm3
Kunci Jawaban Soal OSP Kimia 2011 : B
Soal OSP Kimia 2011 Nomor 3
Di bawah ini ialah energi ionisasi berurutan (dalam kJ mol–1) dari unsur X:
870–1800–3000–3600–5800–7000–13200
Apakah unsur X ini?
A. As
B. I
C. O
D. Te
E. Zr
Pembahasan Soal OSP Kimia 2011 Nomor 3
∆ energi ionisasi terbesar terjadi pada energi ionisasi ke-6 dan ke-7. Maknanya unsur X ketika melepas elektron ke-7 membutuhkan energi yang besar.
Kondisi menyerupai ini pertanda bahwa unsur X telah mencapai kestabilan sehabis melepaskan elektron ke-6 dan relatif butuh energi yang besar kalau akan melepaskan elektron ke-7.
Unsur X ialah unsur yang berada di golongan VI-A atau golongan 16.
Unsur yang terdapat pada golongan tersebut ialah O dan Te. O jauh sulit melepaskan elektron, ia cenderung untuk menarik elektron dari luar sebab jari-jari relatif lebih kecil dibanding Te.
Oleh sebab itu Kunci Jawaban Soal OSP Kimia 2011 : unsur X ialah Te.
Kunci Jawaban Soal OSP Kimia 2011 : D.
Soal OSP Kimia 2011 Nomor 4
Bila air diaduk dengan glukosa, mula-mula akan terbentuk ikatan hidrogen yang berpengaruh antara molekul glukosa dan air, tetapi kalau penambahan air dilanjutkan, ikatan hidrogen akan terputus. Berikut ini, grafik manakah yang terbaik untuk menggambarkan perubahan suhu yang teramati?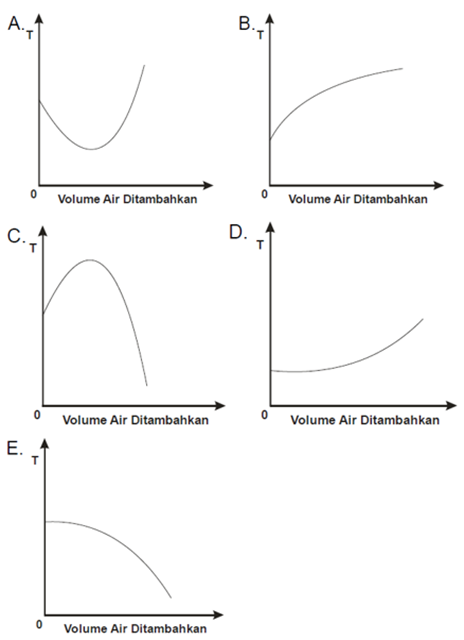
Pembahasan Soal OSP Kimia 2011 Nomor 4
Pada pencampuran air dengan glukosa, panas dilepaskan sebab ikatan hidrogen yang berpengaruh terbentuk antara molekul glukosa dan molekul air, dan suhu meningkat. Tetapi lebih banyak air ditambahkan, panas diserap untuk memutuskan ikatan hidrogen ini, dan suhunya menurun. Grafik yang sesuai ialah grafik C.
Kunci Jawaban Soal OSP Kimia 2011 : C
Soal OSP Kimia 2011 Nomor 5
Nilai perubahan entalpi untuk proses yang digambarkan oleh persamaan ini:
Na(s) → Na+(g) + e–
Adalah sama dengan. . .
A. Energi ionisasi pertama dari natrium
B. Perubahan entalpi penguapan natrium
C. Jumlah energi ionisasi dan afinitas elektron dari natrium
D. Jumlah perubahan entalpi atomisasi dan energi ionisasi pertama dari natrium
E. Jumlah perubahan entalpi atomisasi dan afinitas elektron dari natrium
Pembahasan Soal OSP Kimia 2011 Nomor 5
Na(s) → Na(g); Reaksi perubahan natrium menjadi atom disebut ∆H atomisasi
Na(g) → Na+(g) + e– ; Reaksi pelepasan satu elektron pertama dari atom Na lalu menjadi ion Na+ disebut energi ionisasi pertama.
Kunci Jawaban Soal OSP Kimia 2011 : D
Lanjut ke halaman berikutnya
Download Pembahasan Soal OSP Kimia 2011 (1-10)
Baca juga: Download Pembahasan Soal OSP Kimia 2004 Hingga 2018
Soal OSP Kimia 2011 Nomor 6
Kalor yang dibebaskan dalam reaksi netralisasi berikut ialah –114 kJ.
2NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2H2O(l)
Dengan menggunakan gosip tersebut, berapa nilai yang cocok untuk kalor yang dibebaskan dalam netralisasi berikut?
Ba(OH)2(aq) + 2HCl(aq) → BaCl2(aq) + 2H2O(l)
A. – 57 kJ
B. – 76 kJ
C. – 114 kJ rukim.id
D. – 171 kJ
E. – 226 kJ
Pembahasan Soal OSP Kimia 2011 Nomor 6
Setiap asam berpengaruh yang dinetralkan oleh basa berpengaruh intinya hanyalah reaksi antara ion hidrogen dan ion hidroksida untuk menghasilkan air.
Ion-ion lain yang ada (kation dari basa berpengaruh dan anion dari asam kuat) hanyalah sebagai ion spektator, yang tidak ambil cuilan dalam reaksi. Makara secara umum kalor netralisasi antara asam berpengaruh dengan basa berpengaruh akan menyerupai besarannya.
Kunci Jawaban Soal OSP Kimia 2011 : C
Soal OSP Kimia 2011 Nomor 7
Kesadahan dalam air kran sanggup ditentukan dengan titrasi larutan sampel terhadap pereaksi yang membentuk ion kompleks dengan ion logam terlarut.
Indikator untuk reaksi ini membutuhkan pH larutan yang dijaga sekitar 10. Berikut ini, manakah larutan akua yang sanggup dipakai untuk pekerjaan ini?
A. Amoniak dan amonium klorida
B. Amonium klorida dan asam klorida
C. Natrium etanoat dan asam etanoat
D. Natrium hidroksida dan natrium etanoat
E. Hanya natrium hidroksida
Pembahasan Soal OSP Kimia 2011 Nomor 7
Ini merupakan penerapan konsep larutan penyangga, larutan yang sanggup mempertahankan pH. Karena pH yang dikehendaki di atas 7 (larutan bersifat basa) maka larutan yang cocok ialah larutan penyangga dengan komponen asam lemah dengan basa konjugatnya.
Asam etanoat merupakan asam lemah dan natrium etanoat merupakan garam yang mengandung basa konjugat dari asam lemah asam etanoat.
Kunci Jawaban Soal OSP Kimia 2011 : C
Soal OSP Kimia 2011 Nomor 8
Mengapa silikon tetraklorida bila dilarutkan dalam air akan segera terhidrolisis, sedangkan karbon tetraklorida tidak?
A. Ikatan Si–Cl lebih polar daripada ikatan C–Cl
B. Ikatan Si–Cl lebih lemah daripada ikatan C–Cl
C. Silikon sanggup menggunakan orbital d, sedangkan karbon tidak.
D. Orbital d dari karbon terisi, sedangkan yang silikon tidak
E. Molekul karbon tertraklorida dan molekul silikon tetraklorida mempunyai bentuk yang berbeda
Pembahasan Soal OSP Kimia 2011 Nomor 8
Setidaknya ada dua alasan SiCl4 dapat terhidrolisis sedangkan CCl4 tidak:
(1) C yang hanya mempunyai 2 kulit dan tidak mempunyai subkulit 2d sehingga tidak memungkinkan membentuk ikatan koordinasi dengan molekul air.
Si yang mempunyai kulit ketiga yang terdapat subkulit 3d dan berkemungkinan mengalami hidrolisis sebab adanya orbital 3d yang kosong untuk menampung pasangan elektron dari molekul air membentuk ikatan kovalen koordinasi. rukim.id
(2) Ukuran jari-jari atom sentra Si pada SiCl4 lebih besar dibanding atom sentra C pada CCl4 , sehingga pada Si kurang terlindungi dari serangan molekul air.
Kunci Jawaban Soal OSP Kimia 2011 : C
Soal OSP Kimia 2011 Nomor 9
Titanium mempunyai struktur elektronik 1s2 2s2 2p6 3s2 3p6 4s2 3d2 . Berikut ini, manakah senyawa yang keberadaannya tidak sesuai dengan sifat unsur titanium?
A. K2TiO4
B. K3TiO6
C. TiCl3
D. TiO
E. TiO2
Pembahasan Soal OSP Kimia 2011 Nomor 9
Berdasarkan konfigurasi elektron Ti berkemungkinan:
melepaskan 1 elektron (bilangan oksidasi +1),
melepaskan 2 elektron (bilangan oksidasi +2),
melepaskan 3 elektron (bilangan oksidasi +3),
melepaskan 4 elektron (bilangan oksidasi +4)
Melepaskan elektron lebih dari 4 elektron (bilangan oksidasi lebih dari +4) akan sangat sulit membutuhkan energi yang lebih besar.
Bilangan oksidasi Ti dalam:
K2TiO4 → +6
K3TiO6 → +5
TiCl3 → +3
TiO → +2
TiO2 → +4
Kunci Jawaban Soal OSP Kimia 2011 : A dan B
Soal OSP Kimia 2011 Nomor 10
Berturut-turut, bagaimana masing-masing hibridasi dari atom nomor 1 sampai nomor 4 berikut ini:
A. sp3 sp2 sp3 sp3
B. sp3 sp2 sp3 sp
C. sp3 sp2 sp2 sp
D. sp2 sp sp2 sp3
E. sp2 sp2 sp3 sp
Pembahasan Soal OSP Kimia 2011 Nomor 10
Setiap ikatan dan pasang elektron bebas mewakili 1 orbital.
- N mempunyai 3 ikatan dan 1 PEB
→ 4 orbital → 1s dan 3p → sp3 - C mempunyai 3 ikatan dan 0 PEB
→ 3 orbital → 1s dan 2p → sp2 - N mempunyai 3 ikatan dan 1 PEB
→ 4 orbital → 1s dan 3p → sp3 - N mempunyai 1 ikatan dan 1 PEB
→ 2 orbital → 1s dan 1p → sp
Kunci Jawaban Soal OSP Kimia 2011 : B
Semoga bermanfaat pembahasan soal OSP Kimia 2011 ini. Semoga sukses di Olimpiade Sains Nasional tingkat provinsi dan sanggup masuk OSN 2019.
Download Pembahasan Soal OSP Kimia 2011 (1-10)
Sumber aciknadzirah.blogspot.com